
技術文章
 更新時間:2025-09-18
更新時間:2025-09-18 點擊次數:117
點擊次數:117
蛋白質的泛素化修飾在真核細胞的生命進程中扮演核心角色。Cullin-RING E3泛素連接酶(CRLs)作為泛素-蛋白酶體系統(UPS)中的關鍵組成部分,是哺乳動物細胞內最大的E3酶家族,負責特異性識別、泛素化并降解底物蛋白,從而精密調控多種生理過程。CRL3作為其中一類重要亞型,特異性地利用BTB結構域蛋白作為底物適配子。人類基因組編碼超過180種BTB蛋白,CRL3復合物廣泛參與糖脂代謝、癌癥發生、細胞周期及發育等重要生物學事件。然而,由于CRL3結構復雜,其分子架構與催化機制仍存在大量未知。
2024年2月8日,復旦大學生物醫學研究院孫蕾研究員、陳振國研究員團隊與美國德克薩斯大學西南醫學中心Bruce Beutler院士合作,在《Nature Structural & Molecular Biology》上發表了題為“Dynamic molecular architecture and substrate recruitment of cullin3–RING E3 ligase CRL3KBTBD2"的研究論文。該研究以CRL3KBTBD2對p85α的特異性招募為模型,系統解析了該E3連接酶在催化循環中的動態結構變化與功能機制。

p85α是PI3Kα復合物的調節亞基,與催化亞基p110α共同調節胰島素信號傳導。KBTBD2作為新發現的p85α調控蛋白,在小鼠模型中其缺失會導致p85α累積,引發胰島素信號紊亂,表現為發育遲緩、胰島素抵抗、Ⅱ型糖尿病等表型,甚至導致死亡。研究表明,KBTBD2與CUL3及RBX1組裝成CRL3 KBTBD3復合體,催化p85α的泛素化與降解,從而在代謝穩態中發揮關鍵作用。
2. CRL3 KBTBD2的催化循環涉及哪些動態結構狀態?
本研究成功解析了CRL3 KBTBD2在多個功能狀態下的高分辨率冷凍電鏡結構,包括自組裝、底物招募(與p85α結合)、活化(NEDD8修飾)、去活化(與CSN結合)及底物受體交換(與CAND1結合)等七種狀態,構建了迄今為止最完整的CRL3催化循環模型。
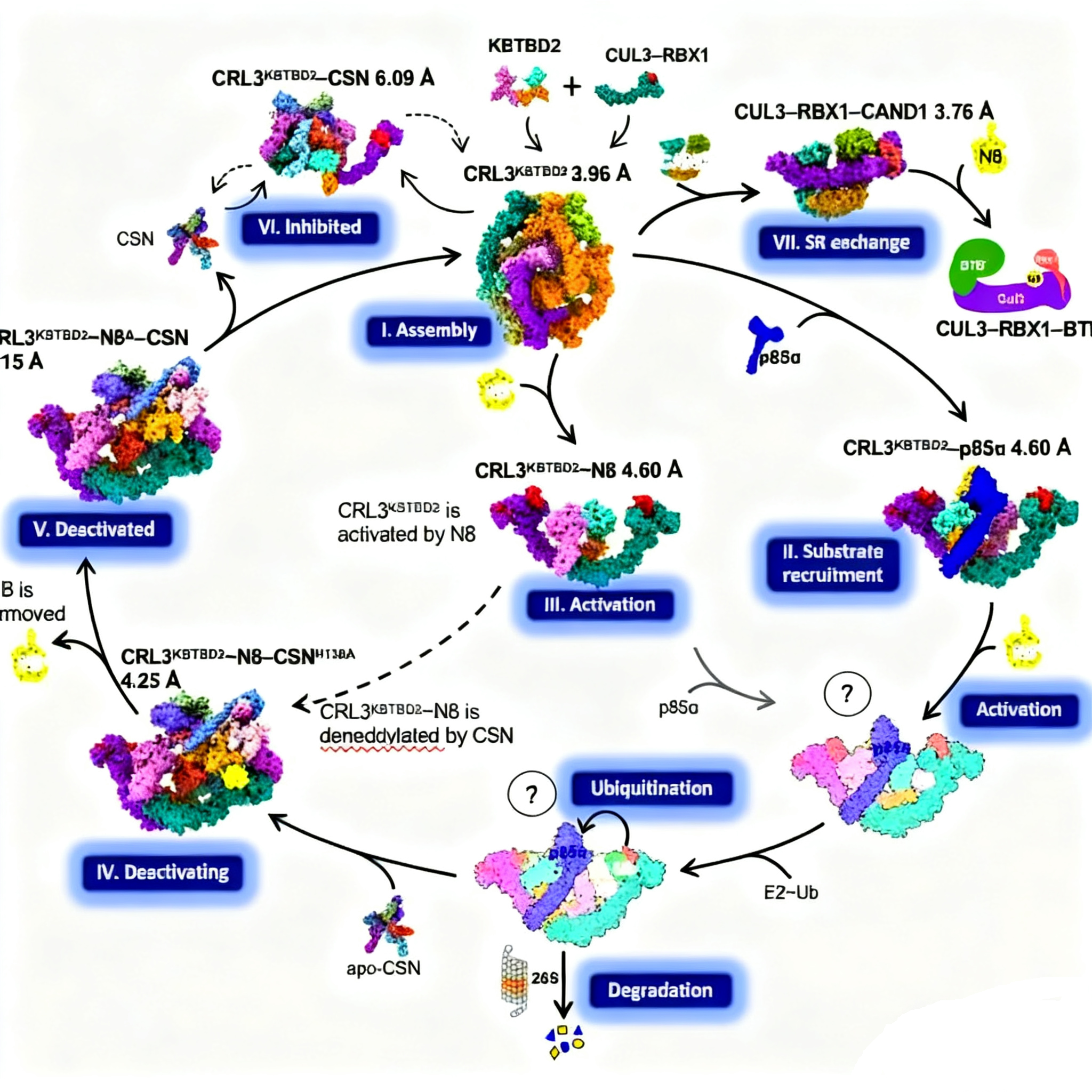
值得注意的是,KBTBD2本身具有二聚化能力,使得CRL3 KBTBD2可形成四聚、六聚甚至八聚體的高級結構,其酶活中心在未結合底物時處于遮蔽狀態。而在與p85α、NEDD8或CSN等因子結合后,復合體逐步解離為活性二聚體形式,暴露出底物結合及催化位點。
3.CRL3如何特異性識別并招募全長底物蛋白?
闡明CRLs家族對底物的識別機制一直面臨巨大挑戰。該研究系統性揭示了CRL3 KBTBD2與全長p85α蛋白的互作模式:KBTBD2通過其BTB-BACK與Kelch結構域協同作用,與p85α形成多界面結合,為底物識別提供高親和力與特異性。該工作彌補了CRLs招募全長底物的結構機制空白,為理解E3連接酶的底物選擇性提供了新視角。
本研究提出CRL3KBTBD2在催化循環中的動態構象變化模型,系統闡釋了其通過結構重組實現底物招募與泛素化的機制。這不僅深化了對CRL3功能的理解,也為針對CRLs的藥物開發提供了結構基礎。
值得關注的是,同期《Nature Structural & Molecular Biology》推出了“泛素化"專題,發表了多篇相關研究及評論,反映出該領域在機制探索與臨床應用方面的持續活躍與重要性。

結語
泛素-蛋白酶體系統在維持蛋白質穩態和細胞功能中發揮核心作用,其失調與多種重大疾病密切相關。目前,以該系統為靶點的藥物研發已在腫瘤治療中取得實質性進展,包括蛋白酶體抑制劑、去泛素化酶抑制劑和泛素化酶調節劑等多類化合物。未來研究將繼續深化對該系統調控機制的理解,推動更具選擇性和高效性的治療策略的開發。
杭州斯達特 志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。