
技術(shù)文章
 更新時(shí)間:2025-09-05
更新時(shí)間:2025-09-05 點(diǎn)擊次數(shù):174
點(diǎn)擊次數(shù):174
在現(xiàn)代分子生物學(xué)與基因工程領(lǐng)域,精準(zhǔn)操控DNA是核心挑戰(zhàn)之一。定點(diǎn)酶切技術(shù)作為一種能夠特異性切割DNA鏈的工具,被譽(yù)為基因編輯的“分子手術(shù)刀"。它不僅在基礎(chǔ)研究中用于解析基因功能,還在生物技術(shù)、醫(yī)學(xué)診斷及治療中發(fā)揮著重要作用。本文將從技術(shù)原理、應(yīng)用場(chǎng)景、優(yōu)勢(shì)與挑戰(zhàn)以及未來發(fā)展方向等方面,全面探討定點(diǎn)酶切技術(shù)的重要性及其影響。
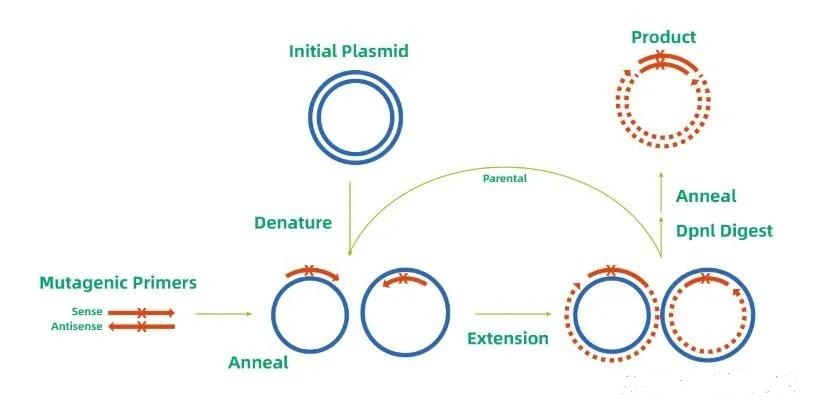
定點(diǎn)酶切技術(shù)是一種通過特異性識(shí)別并切割DNA鏈中特定序列的方法。其核心工具是限制性內(nèi)切酶(restriction endonucleases),這類酶能夠識(shí)別雙鏈DNA上的特定回文序列(如EcoRI識(shí)別GAATTC),并在特定位置切斷磷酸二酯鍵,產(chǎn)生粘性末端或平末端。例如,HindIII識(shí)別AAGCTT序列,并在A與A之間切割,形成粘性末端,便于后續(xù)DNA片段的連接。
此外,隨著基因編輯技術(shù)的發(fā)展,CRISPR-Cas系統(tǒng)已成為定點(diǎn)酶切的重要工具。Cas9蛋白在sgRNA的引導(dǎo)下,能夠精準(zhǔn)結(jié)合到DNA靶點(diǎn)序列,并通過其核酸酶活性實(shí)現(xiàn)雙鏈斷裂。與傳統(tǒng)限制性內(nèi)切酶相比,CRISPR-Cas系統(tǒng)的優(yōu)勢(shì)在于其可編程性——只需設(shè)計(jì)不同的向?qū)NA(gRNA),即可靶向幾乎任何DNA序列,無需受限于固定識(shí)別位點(diǎn)。
定點(diǎn)酶切的工作流程通常包括以下步驟:
識(shí)別靶點(diǎn)序列:酶或復(fù)合物通過特異性結(jié)合域定位到DNA上的目標(biāo)位點(diǎn)。
催化切割反應(yīng):在鎂離子(Mg2?)等輔因子存在下,酶活性中心切斷DNA鏈的磷酸二酯鍵。
產(chǎn)生末端結(jié)構(gòu):切割后形成粘性末端(突出單鏈)或平末端(無突出),為后續(xù)連接、克隆或編輯提供基礎(chǔ)。
這種精準(zhǔn)的切割能力使得定點(diǎn)酶切成為分子克隆、基因敲除和序列修飾的關(guān)鍵技術(shù)。
定點(diǎn)酶切技術(shù)的應(yīng)用范圍極其廣泛,幾乎覆蓋了現(xiàn)代生物學(xué)的所有前沿領(lǐng)域。以下是幾個(gè)典型應(yīng)用場(chǎng)景:
1. 分子克隆與載體構(gòu)建
在重組DNA技術(shù)中,定點(diǎn)酶切是載體和插入片段制備的核心步驟。通過使用相同的限制性內(nèi)切酶處理載體和目的基因,可產(chǎn)生兼容的末端,再利用DNA連接酶將其拼接,形成重組質(zhì)粒。例如,pUC19等常用載體的多克隆位點(diǎn)(MCS)包含多個(gè)酶切位點(diǎn),便于靈活構(gòu)建重組分子。
2. 基因編輯與功能研究
CRISPR-Cas系統(tǒng)通過定點(diǎn)切割引發(fā)DNA雙鏈斷裂(DSB),進(jìn)而激活細(xì)胞內(nèi)的修復(fù)機(jī)制:非同源末端連接(NHEJ)或同源定向修復(fù)(HDR)。NHEJ通常導(dǎo)致基因敲除(knock-out),而HDR可用于引入特定突變或插入外源序列。這一技術(shù)已廣泛應(yīng)用于基因功能研究、疾病模型構(gòu)建及遺傳育種。
3. 醫(yī)學(xué)診斷與治療
在分子診斷中,限制性片段長(zhǎng)度多態(tài)性(RFLP)技術(shù)利用定點(diǎn)酶切檢測(cè)基因突變。例如,某些遺傳病(如鐮刀型貧血癥)會(huì)導(dǎo)致酶切位點(diǎn)改變,通過電泳圖譜差異即可實(shí)現(xiàn)診斷。此外,CRISPR-Cas系統(tǒng)已被用于開發(fā)基因療法,如治療β-地中海貧血的臨床試驗(yàn)已取得初步成功。
4. 合成生物學(xué)與代謝工程
在人工設(shè)計(jì)生物系統(tǒng)中,定點(diǎn)酶切用于模塊化組裝遺傳元件。例如,Golden Gate克隆方法通過Type IIS限制性內(nèi)切酶(如BsaI)實(shí)現(xiàn)多片段無縫拼接,大幅提升了合成基因電路的構(gòu)建效率。
定點(diǎn)酶切技術(shù)的快速發(fā)展離不開其優(yōu)勢(shì),尤其是在精度、靈活性和效率方面的突破:
1. 超高精度與可編程性
傳統(tǒng)限制性內(nèi)切酶的識(shí)別序列通常為4-8bp,理論上每256bp至65kb才會(huì)出現(xiàn)一個(gè)隨機(jī)切點(diǎn),但仍可能因非特異性切割導(dǎo)致脫靶效應(yīng)。而CRISPR-Cas系統(tǒng)通過gRNA設(shè)計(jì)可實(shí)現(xiàn)單一堿基級(jí)別的靶向性,且Cas9變體(如Cas9-HF1)進(jìn)一步降低了脫靶風(fēng)險(xiǎn)。
2. 操作靈活性與通用性
傳統(tǒng)酶切受限于固定序列,而CRISPR-Cas僅需改變gRNA序列即可靶向新位點(diǎn),無需更換酶種類。此外,CRISPR系統(tǒng)還可與多種功能域融合(如堿基編輯器BE4、激活因子dCas9-VPR),實(shí)現(xiàn)切割以外的編輯調(diào)控功能。
3. 高效性與低成本
CRISPR-Cas組件可通過質(zhì)粒表達(dá)或直接遞送(如核糖核蛋白復(fù)合物RNP),在細(xì)胞或體內(nèi)快速生效。相比鋅指核酸酶(ZFN)或TALEN等早期編輯工具,其構(gòu)建周期更短、成本更低,更適合大規(guī)模篩選應(yīng)用。
盡管定點(diǎn)酶切技術(shù)前景廣闊,但其在實(shí)際應(yīng)用中仍存在若干挑戰(zhàn):
1. 脫靶效應(yīng)與安全性問題
CRISPR-Cas系統(tǒng)可能因gRNA與非互補(bǔ)序列結(jié)合而產(chǎn)生脫靶切割,尤其在高濃度酶或長(zhǎng)時(shí)間反應(yīng)條件下。這一問題在臨床治療中尤為關(guān)鍵,目前通過優(yōu)化gRNA設(shè)計(jì)、使用高保真Cas變體(如SpCas9-HF1)及 computational prediction 工具(如CRISPRoff)來緩解。
2. 遞送效率與體內(nèi)應(yīng)用障礙
如何將酶切組件高效遞送至目標(biāo)細(xì)胞(如人體組織)是重大挑戰(zhàn)。病毒載體(如AAV)雖效率較高,但存在免疫原性和容量限制;非病毒方法(如脂質(zhì)納米顆粒LNP)則需平衡毒性與效率。
3. 細(xì)胞修復(fù)機(jī)制的不確定性
DSB修復(fù)依賴細(xì)胞自身機(jī)制,但NHEJ和HDR的效率因細(xì)胞類型和狀態(tài)而異。例如,干細(xì)胞中HDR效率通常低于癌細(xì)胞,這為精準(zhǔn)編輯帶來了變數(shù)。聯(lián)合使用修復(fù)增強(qiáng)劑(如RS-1)或交替編輯策略(如Prime Editing)是當(dāng)前解決方案。
4. 倫理與監(jiān)管爭(zhēng)議
生殖細(xì)胞編輯或生態(tài)級(jí)聯(lián)改造(如基因驅(qū)動(dòng))可能引發(fā)不可逆的生態(tài)或遺傳后果。國(guó)際社會(huì)正逐步建立相關(guān)倫理指南,但技術(shù)發(fā)展速度遠(yuǎn)超法規(guī)更新,需持續(xù)開展跨學(xué)科對(duì)話。
為突破現(xiàn)有局限,定點(diǎn)酶切技術(shù)正朝著更高精度、更低脫靶和更廣應(yīng)用的方向演進(jìn):
1. 新工具開發(fā)與優(yōu)化
新型Cas變體(如Cas12f、CasΦ)具有更小尺寸和更高特異性,適用于體內(nèi)遞送;堿基編輯(Base Editing)和先導(dǎo)編輯(Prime Editing)系統(tǒng)無需DSB即可實(shí)現(xiàn)C→T或A→G等點(diǎn)突變,減少了基因組損傷風(fēng)險(xiǎn)。
2. 多組學(xué)整合與人工智能輔助
結(jié)合單細(xì)胞測(cè)序和蛋白質(zhì)工程數(shù)據(jù),AI算法(如DeepCRISPR)可預(yù)測(cè)gRNA效率與脫靶率,實(shí)現(xiàn)個(gè)性化設(shè)計(jì)。自動(dòng)化平臺(tái)(如液滴微流控)則支持高通量編輯篩選。
3. 臨床轉(zhuǎn)化與產(chǎn)業(yè)化
隨著CRISPR療法(如CTX001用于β-地中海貧血)進(jìn)入III期臨床試驗(yàn),定點(diǎn)酶切技術(shù)有望在未來5-10年內(nèi)成為常規(guī)醫(yī)療手段。合成生物學(xué)公司(如Ginkgo Bioworks)已利用自動(dòng)化酶切平臺(tái)加速菌株改造。
4. 倫理框架與全球化協(xié)作
UNESCO等組織正推動(dòng)全球基因編輯倫理公約,強(qiáng)調(diào)技術(shù)透明性與公眾參與。跨領(lǐng)域合作(生物學(xué)、法學(xué)、社會(huì)學(xué))將確保技術(shù)負(fù)責(zé)任發(fā)展。
定點(diǎn)酶切技術(shù)自限制性內(nèi)切酶發(fā)現(xiàn)以來,已逐步演進(jìn)為基因編輯的核心驅(qū)動(dòng)力。從基礎(chǔ)科研到臨床醫(yī)療,從農(nóng)業(yè)育種到工業(yè)生產(chǎn),其精準(zhǔn)性與靈活性持續(xù)推動(dòng)生命科學(xué)革命。盡管仍存在脫靶風(fēng)險(xiǎn)、遞送挑戰(zhàn)和倫理爭(zhēng)議,但通過工具創(chuàng)新、多學(xué)科融合與全球化治理,定點(diǎn)酶切技術(shù)有望成為解決人類健康、糧食安全和環(huán)境問題的關(guān)鍵利器。未來,隨著技術(shù)不斷成熟,這把“分子手術(shù)刀"將更加精準(zhǔn)地重塑生命藍(lán)圖。
杭州斯達(dá)特 志在為全球生命科學(xué)行業(yè)提供優(yōu)質(zhì)的抗體、蛋白、試劑盒等產(chǎn)品及研發(fā)服務(wù)。依托多個(gè)開發(fā)平臺(tái):重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發(fā)平臺(tái)(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認(rèn)證、ISO9001認(rèn)證、ISO13485。
定點(diǎn)酶切技術(shù):基因工程的精準(zhǔn)“分子手術(shù)刀"
關(guān)于我們
公司簡(jiǎn)介 企業(yè)文化 榮譽(yù)資質(zhì)產(chǎn)品分類
抗體/抗原 蛋白新聞文章
新聞中心 技術(shù)文章聯(lián)系我們
聯(lián)系方式 在線留言 地圖導(dǎo)航15855403091
(全國(guó)服務(wù)熱線)浙江省杭州市上城區(qū)同協(xié)路1279號(hào)西子智慧產(chǎn)業(yè)園7號(hào)樓4層
wangxm@starter-bio.com
關(guān)注公眾號(hào)

Copyright © 2025杭州斯達(dá)特生物科技有限公司 All Rights Reserved 工信部備案號(hào):
技術(shù)支持:化工儀器網(wǎng) 管理登錄 sitemap.xml