
技術文章
 更新時間:2025-09-04
更新時間:2025-09-04 點擊次數:172
點擊次數:172
在生命科學研究和醫學診斷領域,精準定量生物分子是至關重要的一環。酶聯免疫吸附測定(ELISA)作為一種高效、靈敏且特異的檢測技術,自20世紀70年代問世以來,已成為實驗室中重要的工具。其中,大鼠ELISA試劑盒是專門設計用于檢測大鼠樣本(如血清、血漿、組織勻漿或細胞培養上清液)中特定目標分子(如細胞因子、激素、生長因子等)的試劑組合。由于其在大鼠模型研究中的廣泛應用,這類試劑盒在藥物開發、疾病機制研究和毒理學評估中扮演著關鍵角色。本文將以總分總的形式,深入探討大鼠ELISA試劑盒的各個方面,包括其工作原理、類型、操作步驟、數據分析、常見問題及解決方案,以及未來發展趨勢。文章將通過小標題以提問形式展開,每個部分內容詳實,旨在為讀者提供全面的知識框架和實踐指導。
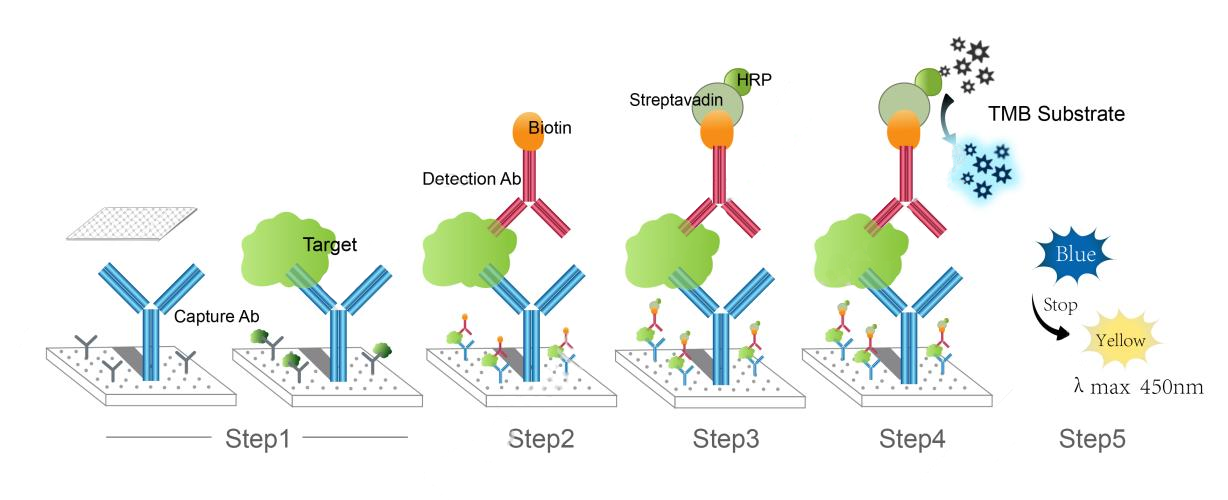
ELISA(Enzyme-Linked Immunosorbent Assay)是一種基于抗原-抗體特異性結合的免疫分析技術,通過酶標記物催化底物產生顯色反應,從而定量或定性檢測樣本中的目標分子。該技術由Engvall和Perlmann于1971年提出,因其高靈敏度、高特異性和操作簡便性,迅速成為生物醫學研究的金標準。對于大鼠研究而言,ELISA技術的重要性不言而喻。大鼠作為常見的實驗動物模型,廣泛應用于人類疾病研究(如糖尿病、心血管疾病、神經退行性疾病等)、藥物毒理學測試和免疫學實驗。例如,在藥物開發中,研究人員需要評估大鼠體內細胞因子(如IL-6、TNF-α)的水平變化,以了解藥物的免疫調節效果。大鼠ELISA試劑盒專為大鼠樣本優化,避免了種屬交叉反應,確保了檢測結果的準確性。此外,ELISA技術的高通量能力(可同時處理多個樣本)使其適合大規模篩查,從而加速研究進程。總之,ELISA技術不僅為大鼠研究提供了可靠的工具,還推動了轉化醫學的發展,幫助將動物實驗成果應用于人類健康。
ELISA技術的基本原理依賴于抗原和抗體的特異性結合。簡單來說,試劑盒中的微孔板預先包被了捕獲抗體(針對目標分子),當加入大鼠樣本時,目標抗原(如蛋白質)與捕獲抗體結合。隨后,加入檢測抗體(通常與酶如HRP或ALP偶聯),形成“捕獲抗體-抗原-檢測抗體"復合物。最后,加入底物(如TMB),酶催化底物產生顏色變化,其強度與目標抗原濃度成正比,可通過酶標儀測量吸光度值進行定量。這種設計使得ELISA能夠檢測低至pg/mL級別的分子,遠超其他傳統方法如Western blot。對于大鼠研究,試劑盒還經過特殊優化,例如使用大鼠特異性抗體,以避免與其他物種(如小鼠或人類)的交叉反應,從而減少假陽性結果。正因為這些優勢,大鼠ELISA試劑盒在基礎研究和臨床前研究中非常重要。
大鼠ELISA試劑盒根據檢測原理和設計,可分為幾種主要類型:直接ELISA、間接ELISA、夾心ELISA(Sandwich ELISA)和競爭性ELISA。每種類型各有優缺點,適用于不同場景。夾心ELISA是最常見的類型,因為它具有高靈敏度和特異性,適合檢測復雜樣本中的低豐度蛋白質,如細胞因子或激素。它使用兩種抗體(捕獲抗體和檢測抗體)分別結合目標抗原的不同表位,從而減少非特異性結合。例如,在檢測大鼠IL-10水平時,夾心ELISA試劑盒能準確量化血清中的濃度,即使存在其他干擾蛋白質。直接ELISA操作簡單,但靈敏度較低,通常用于篩選或定性分析;間接ELISA通過二級抗體放大信號,提高了靈敏度,但可能增加背景噪聲。競爭性ELISA則適用于小分子物質(如激素或藥物代謝物)的檢測,其中樣本中的抗原與標記抗原競爭結合抗體,信號強度與抗原濃度成反比。
選擇適合的大鼠ELISA試劑盒時,需考慮多個因素。首先,明確研究目標:是定量還是定性檢測?目標分子是什么(例如,是細胞因子還是激素)?樣本類型是什么(血清、組織勻漿或細胞培養上清液)?例如,如果檢測大鼠TNF-α(一種炎癥標志物),應選擇夾心ELISA試劑盒,因為它能處理復雜樣本并提供高精度結果。其次,評估試劑盒的性能參數:靈敏度、檢測范圍(標準曲線范圍)、特異性和回收率。靈敏度應足以檢測樣本中的預期濃度——例如,大鼠血清中細胞因子濃度通常在pg/mL級別,因此試劑盒的檢測限需低于10 pg/mL。特異性方面,確保抗體對大鼠目標分子高度特異,無交叉反應。此外,參考廠家提供的驗證數據(如線性稀釋實驗和 spike-and-recovery 實驗)以確保準確性。成本和時間也是考慮因素:一些試劑盒提供即用型試劑,節省時間但價格較高;而其他可能需要優化步驟,但更經濟。總之,通過綜合評估這些因素,研究人員可以選出適合其需求的試劑盒,避免浪費資源和得到不可靠結果。
操作大鼠ELISA試劑盒是一個多步驟過程,需要嚴格遵循protocol以確保結果準確性。典型步驟包括:樣本制備、試劑準備、孵育、洗滌、顯色和讀數。首先,樣本制備是關鍵:大鼠樣本(如血液或組織)需正確處理以避免降解。例如,血液樣本應離心分離血清或血漿,并在-80°C保存以防蛋白質降解。樣本稀釋需根據預實驗確定,以避免Hook效應(高濃度抗原導致信號飽和)。其次,試劑準備:所有試劑(如標準品、抗體和底物)應在室溫平衡后使用,避免反復凍融。標準品系列稀釋必須精確,以生成可靠的標準曲線。
孵育和洗滌步驟是ELISA的核心。孵育時間溫度需嚴格控制——通常,抗體孵育在37°C進行1-2小時,以確保充分結合。洗滌步驟使用PBS或廠家提供的緩沖液,以去除未結合物質,減少背景噪聲。操作中需避免孔間交叉污染。顯色反應加入底物后,應在暗處孵育(通常15-30分鐘),然后加入終止液(如硫酸)停止反應。最后,使用酶標儀在特定波長(如450 nm for TMB)測量吸光度值。數據分析時,通過標準曲線計算樣本濃度,標準曲線應以吸光度值為Y軸,標準品濃度為X軸,采用四參數邏輯(4-PL)曲線擬合以獲得最佳線性范圍。
注意事項包括:避免試劑污染(使用無菌吸頭和高純度水)、確保板孔均勻涂覆(避免氣泡)、和進行內部質量控制(如添加陽性/陰性對照)。常見錯誤如洗滌不充分(導致高背景)或孵育時間不足(導致信號弱),可通過預實驗優化。此外,記錄所有操作細節以備復查。正確操作不僅能提高數據可靠性,還能延長試劑盒 shelf life。總之, meticulous attention to protocol是成功運行ELISA的關鍵。
數據分析是大鼠ELISA實驗的最后一步,但至關重要。原始吸光度值需通過標準曲線轉換為濃度值。標準曲線應覆蓋預期樣本濃度范圍,且R2值(相關系數)大于0.99才可靠。軟件如Excel或專用ELISA分析工具可用于曲線擬合(常用4-PL或線性回歸)。計算樣本濃度時,需考慮稀釋因子,并減去背景值(如空白孔吸光度)。結果 interpretation應結合生物學背景:例如,如果檢測大鼠應激激素 corticosterone,濃度升高可能表示應激反應增強。
常見問題包括:高背景噪聲、低信號、或標準曲線線性差。高背景通常 due to 洗滌不充分、抗體濃度過高或非特異性結合——解決方案包括增加洗滌次數、優化抗體稀釋度或使用封閉劑(如BSA)。低信號可能源于樣本降解、試劑失效或孵育時間不足——可通過新鮮制備樣本、檢查試劑有效期和延長孵育時間來解決。標準曲線問題(如點分散)往往由稀釋錯誤或板間變異引起,應重復實驗并使用同一批試劑。此外,Hook效應(高濃度樣本顯示假低值)可通過樣本稀釋測試避免。
質量控制措施如添加內部對照和重復樣本,能提高數據可信度。統計分析(如t-test或ANOVA)應用于比較組間差異,但需確保數據正態分布。總之,仔細分析和 troubleshooting 可提升ELISA數據的價值,為研究提供可靠依據。
隨著技術進步,大鼠ELISA試劑盒正朝著更高靈敏度、自動化和多重檢測方向發展。未來,納米材料和數字ELISA等創新可能將檢測限推至fg/mL級別, enabling 更早疾病診斷。自動化平臺整合 robotics 和AI,將減少人為誤差,提高 throughput。多重ELISA(如Luminex技術)允許同時檢測多個指標,節省樣本和時間。此外, point-of-care ELISA設備可能使現場檢測成為現實,助力個性化醫療。這些進步將深化大鼠模型在轉化研究中的作用,推動生命科學前沿。
總結來說,大鼠ELISA試劑盒是強大且多功能的工具,通過理解其原理、類型、操作和數據分析,研究人員可有效利用它來揭示生物過程。盡管挑戰如標準化存在,但未來創新 promise 更精準和高效的應用。無論是基礎研究還是藥物開發,ELISA技術將繼續在大鼠研究中發光發熱。

杭州斯達特 志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。
大鼠ELISA試劑盒:從原理到應用的全面解析